| 我室发展智能PROTAC技术并实现活体层次蛋白质靶向降解 |
| 时间:2022-11-10 浏览:次 |
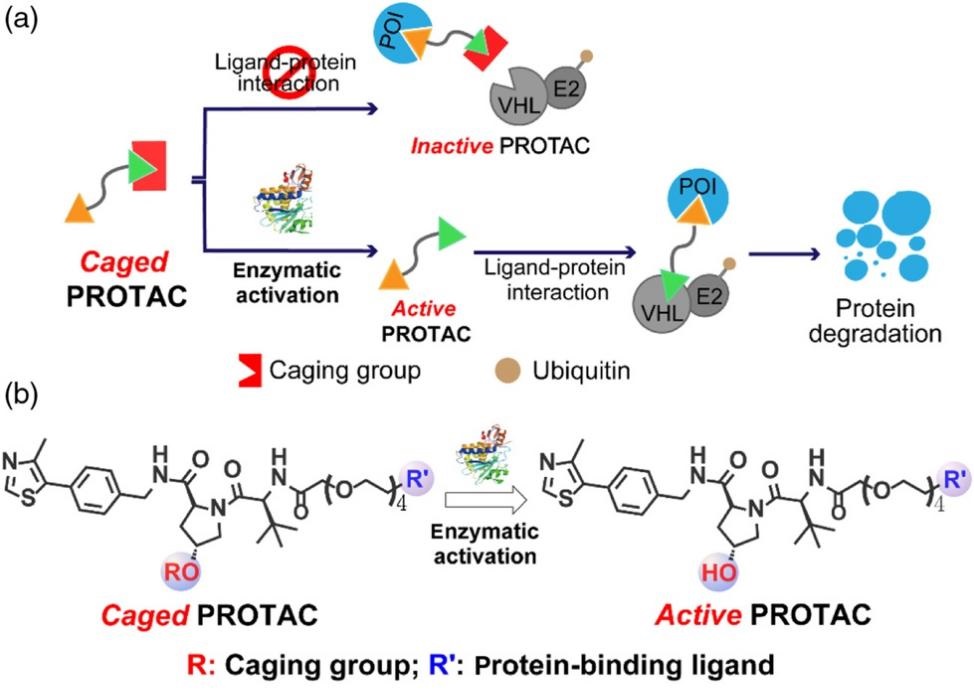
PROTAC(proteolysis-targeting chimeras)是一种利用细胞内泛素-蛋白酶体(Ubiquitin-Proteasome System, UPS)选择性降解靶标蛋白的新技术。与传统小分子或者抗体通过“占据驱动”的模式抑制蛋白质活性不同,PROTAC可以催化当量分子实现靶蛋白的降解,在化学生物学及药物发现研究中得到了广泛应用。然而,利用PROTAC降解靶标蛋白质时存在一定的脱靶效应及非特异性,并产生毒副作用。因此,设计新型PROTAC分子调控蛋白质降解的靶向性对于蛋白质化学生物学研究具有重要意义。 在科技部、基金委和中国科学院的支持下,我室汪铭课题组通过设计PROTAC分子中泛素招募配体的化学修饰,抑制其泛素招募活性。进一步,利用肿瘤细胞特异的化学微环境,如活性氧、酶等催化泛素招募配体的去修饰反应,实现PROTAC分子的智能激活。基于这一原理设计的Pro-PROTAC在正常细胞中处于惰性状态,而在肿瘤细胞中发生选择性激活并降解表观遗传调节因子BRD4等蛋白,为基于智能PROTAC及蛋白质靶向降解策略的抗肿瘤研究提供了新方法,论文近期发表于 CCS Chem. 2022, DOI: 10.31635/ccschem.022.202101529。 图1 酶催化反应调控的智能PROTAC靶向降解蛋白质 近期,他们通过设计PROTAC分子(dGPX4)降解细胞内谷胱甘肽过氧化酶4 (GPX4),用于抑制脂质过氧化物还原,首次报道了基于PROTAC技术诱导细胞铁死亡(Ferroptosis)的策略。进一步,利用课题组发展的脂质体药物递送系统靶向肿瘤组织递送dGPX4,实现了活体层次GPX4蛋白的高效、选择性降解,并诱导肿瘤细胞铁死亡,其效率明显优于GPX4小分子抑制剂ML162。研究同时发现,利用脂质体递送 dGPX4的策略显著改善了PROTAC分子的靶向性和毒副作用,为解决PROTAC技术及活体层次蛋白质靶向降解研究中的瓶颈问题提供了新策略,相关研究成果近期发表于Angew. Chem. Int. Ed. 2022, 61, e202206277, 第一作者为博士研究生梁春菁和罗添丽,通讯作者为汪铭研究员。 图2 dGPX4高效、选择性降解肿瘤组织GPX4并诱导细胞铁死亡 |
|
附件下载
|
| 【打印本页】【关闭本页】 |