| 我室在蛋白质药物递送及神经化学生物学应用方面取得系列进展 |
| 时间:2021-11-05 浏览:次 |
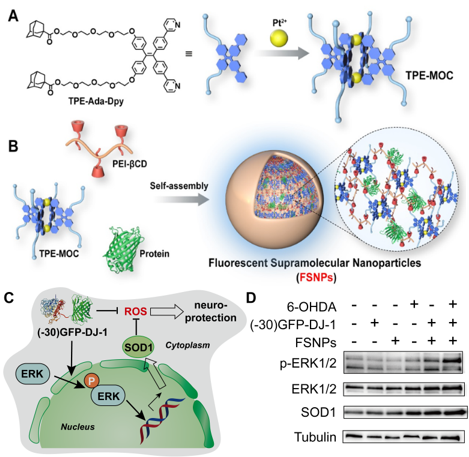
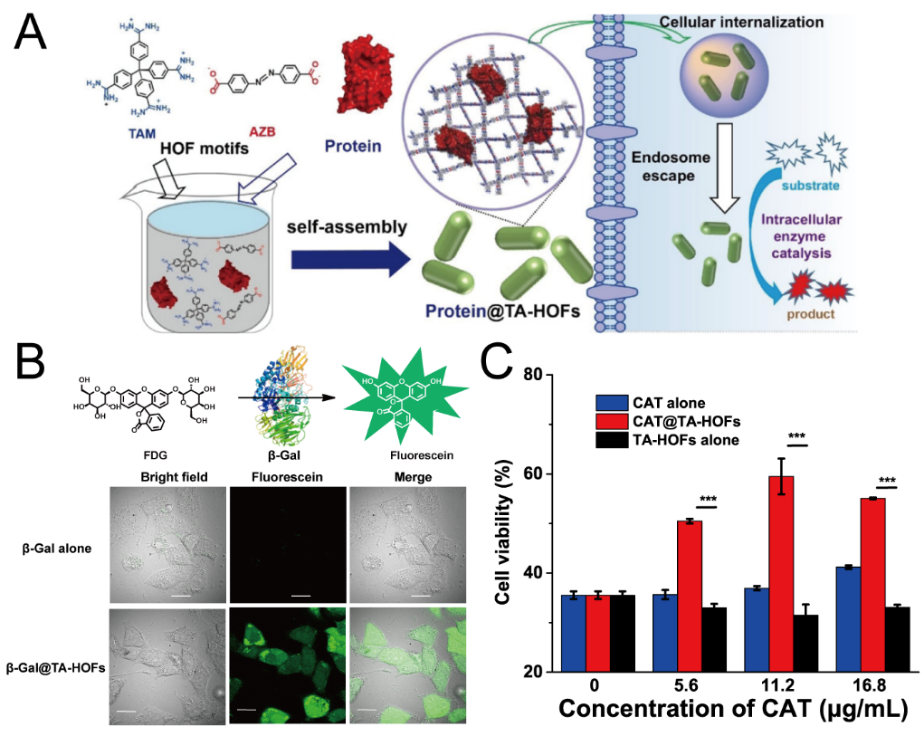
蛋白质是生命活动的主要执行者。人类疾病的发生、发展与细胞内蛋白质的表达异常或功能缺失密切相关。因此,活细胞层次递送蛋白质药物对于生命过程的化学干预、疾病诊断和治疗研究具有重要意义。 在国家自然科学基金委、科技部和中国科学院的支持下,我室汪铭课题组近来围绕蛋白质药物智能递送开展了系统研究,先后发展了阳离子脂质体以及金属有机框架等载体,探索了载体对细胞微环境的响应性及胞内降解过程,实现了细胞及活体层次蛋白质药物的智能递送及功能调控(Acc. Chem. Res. 2019, 52, 665-675; Angew. Chem. Int. Ed. 2021, 60, 8596-8606)。 近期,该课题组通过设计配位超分子自组装体及其在主-客体化学作用下与蛋白质的层级组装,构建了新型超分子纳米颗粒(Supramolecular Nanoparticles, SNPs)。研究发现SNPs可被细胞摄取,并递送蛋白质进入细胞。基于这一策略,他们实现了多种蛋白质药物的细胞递送,并进一步通过递送CRISPR/Cas9基因编辑核酸酶实现细胞基因表达调控(Angew. Chem. Int. Ed. 2021, 60, 5429-5435)。最近,他们设计了四苯乙烯(TPE)衍生物的配位自组装体系,利用TPE的聚集诱导荧光性质(AIE),构建了M2L4型荧光金属-有机笼TPE-MOC。通过调控TPE-MOC和聚乙烯亚胺(PEI)衍生物的层级组装,制备了荧光超分子纳米颗粒(FSNPs)。研究发现上述组装过程可高效包封、递送蛋白进入细胞,并利用FSNPs的光学性质实现了蛋白质递送后在细胞内转运过程示踪。更为重要的是,FSNPs可高效递送蛋白质进入神经细胞,为神经生理病理研究及神经退行性疾病的生物治疗提供了新策略。DJ-1是对细胞氧化还原环境敏感的分子伴侣,其基因突变或功能缺失与帕金森综合症等神经退行性疾病密切相关。研究发现FSNPs递送DJ-1蛋白到神经细胞后可激活MAPK(丝裂原活化蛋白激酶)信号通路终端激酶ERK(细胞内调节激酶)的磷酸化修饰,进而上调超氧化物歧化酶(SOD)表达,实现神经细胞氧化应激水平的调控(Angew. Chem. Int. Ed. 2021, DOI: 10.1002/anie.202111213),上述论文通讯作者为汪铭研究员,第一作者为课题组博士后刘计。 在分子层次调控蛋白质与递送载体之间的相互作用对于蛋白质递送至关重要。然而,蛋白质分子结构复杂,与载体之间的组装多通过静电作用实现,极大限制了组装体的稳定性及适用的蛋白质范围。鉴于此,他们设计四(4-脒苯基)甲烷(TAM)与4,4’-偶氮苯二羧酸(AZB)的氢键组装体系,构建了氢键-有机框架结构(TA-HOFs)。利用HOFs前体与蛋白质残基(谷氨酸、天冬氨酸、赖氨酸、精氨酸等)之间的氢键作用,实现了蛋白质在HOFs中的包封。这一组装过程受蛋白质的物理化学性质影响较小,对具有不同电荷、尺寸的蛋白质均表现高效包封效果。研究发现,HOFs包封过程对蛋白质的活性影响小,可递送蛋白质进入细胞,并用于胞内酶催化反应,且包封过氧化氢酶(catalase)的CAT@TA-HOFs可以催化神经细胞中活性氧物质降解,调控细胞在神经毒素刺激时的氧化应激水平,为基于细胞内酶催化反应的神经退行性疾病治疗提供了新方法(Angew. Chem. Int. Ed. 2021, 60, 22315-22321)。这一研究成果发表后,被Nature Reviews Chemistry作为研究亮点进行了报道(Nat. Rev. Chem. 2021, 5, 670),论文通讯作者为汪铭研究员,第一作者为课题组博士研究生唐佳抗。 |
|
附件下载
|
| 【打印本页】【关闭本页】 |