| 我室在金属抗肿瘤药物传输机理研究方面取得新进展 |
| 时间:2013-08-05 浏览:次 |
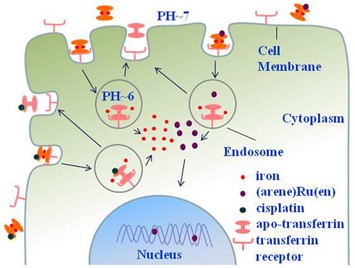
人转铁蛋白(hTf)是一类单链糖蛋白,其功能是在血液中转运铁离子。癌细胞的快速增殖需要大量的铁离子,细胞膜上的转铁蛋白受体(hTfR)通常高表达。由于镓(III)、铟、钌(III)、钛(IV)等金属与hTf形成的复合物仍然可以被hTfR识别,通过TfR介导的内吞途径进入细胞内。所以,以转铁蛋白作为金属抗肿瘤药物的载体,实现抗肿瘤药物向癌细胞的靶向传输引起研究人员的广泛关注。 在国家自然科学基金委、科技部和中国科学院的支持下,活体分析化学院重点实验室多靶点药物设计与分析课题组的研究人员一直致力于发展和建立质谱分析新方法,研究金属抗肿瘤药物和蛋白质的相互作用及其对药物传输、代谢和药效的影响。综合应用分子模拟和LC-MS分析,他们研究发现有机金属钌抗肿瘤药物中的芳烃配体能调控金属钌中心与血清白蛋白中自由巯基的结合和诱导巯基的氧化 (Chem. Eur. J. 2009, 15, 6586-6594);LC-MS/MS研究表明,抗肿瘤药物顺铂通过交联配位,占据人血清白蛋白中生命元素锌的结合位点,可能导致接受顺铂治疗的病人出现锌缺乏综合征 (Chem. Commun. 2011, 47, 6006-6008)。他们还比较研究了顺铂和钌基金属抗癌药物与金属硫蛋白之间的相互作用,发现在生理条件下,顺铂取代金属硫蛋白中锌离子的能力明显比钌基药物强,有可能是钌基抗肿瘤药物的毒副作用较顺铂低的原因之一 (Int. J. Mass Spectrom. 2011, 307, 79-84)。 在前期工作的基础上,多靶点药物设计与分析课题组的研究人员综合应用HPLC-ESI-MS、分子模拟和激光共聚焦显微成像等方法,比较研究了钌基金属抗癌配合物和顺铂与人转铁蛋白(hTf)的相互作用。研究发现钌基配合物倾向于与蛋白表面的组氨酸残基结合,而顺铂除与组氨酸残基结合之外,还能与裸露的蛋氨酸残基配位。但是,钌或铂的配位都不影响铁离子与hTf的结合,Ru (或Pt)-Fe-hTf多元复合物仍然可以被hTfR识别,通过hTfR介导的内吞过程进入细胞内。不同的是,与hTf结合的钌配合物进入细胞后能被释放,进而与核内的DNA结合,因而其抗肿瘤活性得到很好的保留。但顺铂与hTf结合后,其细胞摄入能力和与DNA结合能力大大降低,导致其抗肿瘤药物显著降低。这些发现表明,hTf可能作为有机金属钌抗癌化合物靶向传输的载体,但其与顺铂的不可逆结合可能使顺铂失活,或导致顺铂的毒副作用。该工作发表在近期的Inorg. Chem. (2013, 52, 5328-5338)上。
|
|
附件下载
|
| 【打印本页】【关闭本页】 |